Eine Herztransplantation wird notwendig, wenn das eigene Herz unwiederbringlich zu versagen droht. Die Patienten leiden an einer Herzinsuffizienz („Herzschwäche“) im Endstadium. Das bedeutet, sie sind, um zu überleben, bereits auf hochdosierte, kreislaufwirksame Medikamente oder Apparate wie zum Beispiel ein Sauerstoffgerät, einen implantierten Defibrillator oder ein Herzunterstützungssystem angewiesen. Mehr zu Herzunterstützungssystemen erfahren Sie hier.
Man unterscheidet eine akute Herzinsuffizienz, die sich innerhalb von Stunden bis Tagen entwickelt, von einer chronischen Herzinsuffizienz, die im Verlauf von Monaten bis Jahren voranschreitet. Unter den Patienten, die für eine Herztransplantation angemeldet werden, leiden die meisten an einer chronischen Herzschwäche. Eine Sonderstellung nehmen Kinder ein, die mit einem schweren Herzfehler zur Welt kommen: Ihr Gesundheitszustand verschlechtert sich im Vergleich zur chronischen Herzschwäche bei Erwachsenen oft schneller. Eine Herztransplantation ist daher rascher notwendig.

iStock-1217537099_arto_canon
Welche Erkrankungen können zu einer Herzinsuffizienz führen?
Patienten, die vor einer Herztransplantation stehen, befinden sich zumeist im Stadium IV der Klassifikation der New York Heart Association (NYHA) – dem Endstadium der Herzschwäche. Es gibt verschiedene Erkrankungen des Herzens, die zu einer chronischen Herzinsuffizienz führen können.
Die häufigsten Ursachen für diese schwere Form des Herzversagens sind Herzmuskelerkrankungen, Erkrankungen der Herzkranzgefäße (koronare Herzkrankheit) sowie Erkrankungen der Herzklappen. Seltenere Ursachen sind systemische Speicherkrankheiten, wie zum Beispiel eine Amyloidose oder der Morbus Fabry, eine seltene, angeborene Stoffwechselstörung, die viele Organe betreffen kann.
Bei Herzmuskelerkrankungen (Kardiomyopathien) ist das Muskelgewebe des Herzens zu schwach, um ausreichend Blut in den Blutkreislauf zu pumpen. Sie können zum einen genetisch bedingt sein und treten dann auch oft familiär gehäuft auf. Zum anderen können Kardiomyopathien sich auch nach einer Herzmuskelentzündung (Myokarditis) ausbilden. Diese Entzündung wird meist durch eine Virus-Infektion verursacht und läuft mitunter unbemerkt ab. Oft kommt es dann Monate oder Jahre später zur Ausbildung einer Herzinsuffizienz.
Bei der koronaren Herzkrankheit (KHK) kommt es zur Arteriosklerose der Herzkranzgefäße. Die Gefäße sind verengt und verkalkt und können den Herzmuskel nicht mehr ausreichend mit Sauerstoff versorgen. Die KHK erhöht das Risiko für einen Herzinfarkt, in dessen Folge die Pumpkraft des Herzens nachlassen kann.
Die Herzklappen können verengt sein oder nicht mehr richtig schließen. In beiden Fällen pumpt das Herz mit jedem Herzschlag nicht die optimale Menge an Blut in das Gefäßsystem.
Bei den systemischen Speichererkrankungen kommt es zu einer Ablagerung verschiedener Stoffe im Herzen, wodurch seine Funktion zunehmend eingeschränkt wird.
Unabhängig davon, welche Erkrankung die Herzinsuffizienz verursacht hat: Bei allen Betroffenen treten ähnliche Symptome (Beschwerden) auf.
Symptome einer chronischen Herzinsuffizienz
Wenn das Herz schwächer wird, kann es nicht mehr genug Blut in den Kreislauf pumpen, um die Organe ausreichend mit Sauerstoff zu versorgen. Menschen mit einer Herzschwäche bemerken dies vor allem am Rückgang ihrer körperlichen Leistungsfähigkeit: Zunächst treten Beschwerden nur bei stärkeren Belastungen, wie zum Beispiel bei Sport, auf. Im weiteren Krankheitsverlauf fühlen sich die Betroffenen so schwach, dass auch Tätigkeiten im Alltag zu einer Herausforderung werden.
Typische Beschwerden (Symptome) einer Herzinsuffizienz sind zum Beispiel:
-
Erschöpfung, Leistungsminderung
-
Luftnot (je nach Stadium bei Belastung oder in Ruhe)
-
Ödeme (Wassereinlagerungen) – meist in den Beinen
-
Herzrhythmusstörungen (Arrhythmien)
-
Tachykardie (schneller Herzschlag, Herzrasen)
-
Angina pectoris (krampfartige Schmerzen im Brustkorb)
-
Blass- oder Blauverfärbung der Lippen und Nagelbetten
-
gehäuftes nächtliches Wasserlassen (Nykturie, nächtlicher Harndrang)
NYHA I: Keine Beschwerden, normale körperliche Belastbarkeit
NYHA II: Beschwerden/Luftnot bei stärkerer körperlicher Belastung
NYHA III: Beschwerden/Luftnot schon bei leichter körperlicher Belastung
NYHA IV: Beschwerden/Luftnot in Ruhe, Bettlägerigkeit
Weitere Informationen zur Herzinsuffizienz finden Sie auf der Webseite „Ratgeber Herzinsuffizienz“.
Warten auf die Herztransplantation
Aufgrund des Mangels an Spenderorganen konnten in den letzten Jahren in Deutschland jährlich nur rund 300 Herztransplantationen durchgeführt werden, jedoch mit aktuell wieder steigender Tendenz. Gleichzeitig standen rund 150 mehr Herzinsuffizienz-Patienten auf der Warteliste, als Transplantationen durchgeführt werden konnten. Die Wartezeit bis zur Herztransplantation wird oft mit Herzunterstützungssystemen überbrückt. Sie werden auch künstliche Herzpumpen oder kurz künstliches Herz genannt. Bei Patienten, die durch Herzrhythmusstörungen bedroht sind, können Ärzte einen Mini-Defibrillator (ICD) implantieren. Dieser kann schnelle Herzrhythmusstörungen sofort bei Auftreten wieder beenden. Mit dieser technischen Unterstützung überleben Patienten oft mehrere Jahre. Mehr zum Mini-Defibrillator erfahren Sie hier.
Für von einer Herzinsuffizienz Betroffene und deren Angehörige kann es zur Bewältigung des Alltags und für den Umgang mit der Erkrankung sehr hilfreich sein, sich Unterstützung durch eine Patientenorganisation oder Selbsthilfegruppe zu suchen.
Herzunterstützungssysteme
Es gibt verschiedene Arten von Herzunterstützungssystemen (Ventricular Assist Devices, VAD). Der Arzt sucht für jeden Patienten individuell ein Gerät aus, das zur Herzschwäche beziehungsweise zur auslösenden Herzerkrankung passt. Je nachdem, welche Herzkammer unterstützt werden soll, implantiert man ein linksventrikuläres (LVAD) oder (sehr selten) ein rechtsventrikuläres (RVAD)
Unterstützungssystem. In den meisten Fällen reicht eine Unterstützung der linken Herzkammer mittels LVAD aus.
Benötigen beide Herzkammern eine mechanische Unterstützung, so werden sowohl ein LVAD als auch ein RVAD implantiert – man spricht dann von biventrikulärer Unterstützung (BVAD). Herzunterstützungssysteme sind elektromagnetisch arbeitende Systeme, die operativ im Brustkorb platziert werden. Das eigene Herz verbleibt ebenfalls. Eine Verbindungsleitung (Driveline) führt nach außen zum Controller und zu den Akkus des Gerätes.
Wichtig zu wissen: Da sich der Gesundheitszustand nach Einsatz eines Herzunterstützungssystems in der Regel stabilisiert, wird man auf der Warteliste für eine Herztransplantation nicht mehr mit „High Urgency" (HU), also als „hochdringlich“, gelistet. Erst bei Auftreten schwerwiegender Komplikationen am VAD, die einen VAD-Austausch notwendig machen (zum Beispiel Blutung, Systemthrombose, Embolie, technischer Defekt) oder progredientes Rechtsherzversagen am LVAD, ist wieder eine HU-Listung möglich.
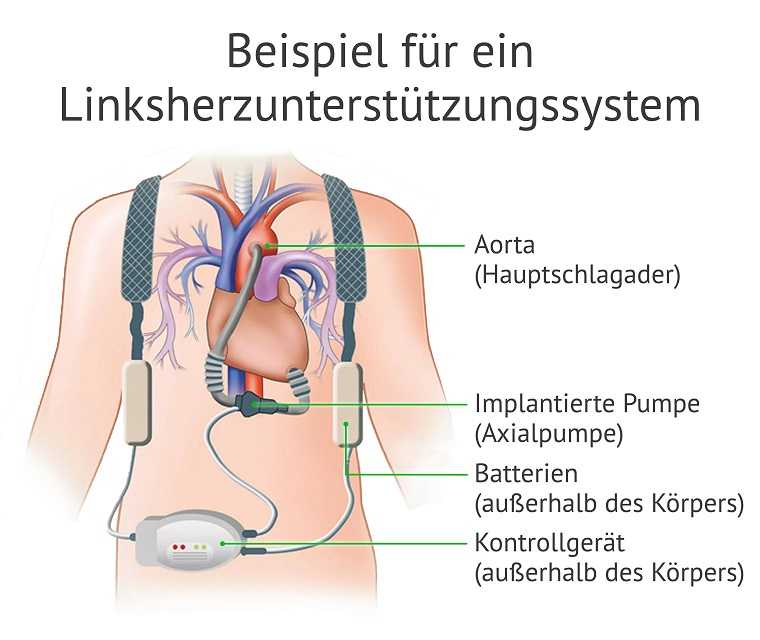
Novartis
Häufig wird ein Linksherzunterstützungssystem eingesetzt, wie es in der Abbildung dargestellt ist: Eine Pumpe drainiert Blut aus der linken Herzkammer (dem linken Ventrikel) und pumpt es in die Aorta. Die Pumpe ist über ein Kabel mit einem Kontrollgerät verbunden, das der Patient mit sich trägt. Für den Betrieb der Pumpe und des Kontrollgerätes muss eine ständige Stromzufuhr gewährleistet sein. Daher tragen die Patienten immer Akkus bei sich, die eine Stromzufuhr von etwa vier bis sechs Stunden gewährleisten.
Alle Träger eines Herzunterstützungssystems müssen zusätzlich zu ihren Herzinsuffizienz-Medikamenten regelmäßig gerinnungshemmende Präparate („Blutverdünner“, zum Beispiel Marcumar® und zusätzlich weitere Wirkstoffe) einnehmen. Denn es können sich Blutgerinnsel bilden, wenn Blut in Kontakt mit Fremdstoffen kommt.
Unterstützungssystem oder Herztransplantation?
Die Überlebenswahrscheinlichkeit ist für Patienten mit Linksherzunterstützungssystemen fast so gut wie nach einer Herztransplantation: Ein Jahr nach dem Einsetzen des Gerätes leben noch etwa 70 Prozent der Patienten, nach einer Transplantation sind es 73 bis 76 Prozent. Auch die körperliche Leistungsfähigkeit ist bei beiden Behandlungsverfahren auf vergleichbarem Niveau. In einer Befragung schätzten sich Patienten nach einer Herztransplantation in den Kategorien „körperliche Funktionsfähigkeit“, „Vitalität“ und „psychisches Wohlbefinden“ allerdings besser ein als Patienten mit Linksherzunterstützungssystemen.
Künstliches Herz
Bei einem sogenannten künstlichen Herz (Total Artificial Heart, TAH) wird das erkrankte Herz fast komplett entfernt und an dessen Stelle eine künstliche Blutpumpe mit zwei Kammern implantiert. Diese TAH-Pumpen sind sehr risikoträchtig, da es zu mechanischen Defekten und der Verstopfung von Blutgefäßen (Embolien) kommen kann. Kunstherzen werden bei einer Herzinsuffizienz im Endstadium daher nur in Ausnahmefällen und bei besonderer Indikation implantiert.
Moderne Herzunterstützungssysteme (LAVD, RVAD) sind mechanisch stabiler und daher für einen längeren Zeitraum einsetzbar als komplette Kunstherzen oder ältere Generationen der Unterstützungssysteme.
Mini-Defibrillatoren bei Arrhythmien
Neben Erkrankungen des Herzmuskels und der koronaren Herzkrankheit können auch Herzrhythmusstörungen zu einer Herzschwäche führen und die Pumpfunktion des Herzens stark einschränken. Im Endstadium der Herzinsuffizienz kann die Wartezeit bis zur Transplantation mithilfe eines implantablen, vollautomatischen Mini-Defibrillator überbrückt werden. Dieser wird auch Implantable Cardioverter-Defibrillator (ICD) genannt. Der Defibrillator wird ähnlich wie ein Herzschrittmacher im Brustbereich unter der Haut platziert. Sobald eine gefährliche Arrhythmie wie z.B. ein Kammerflimmern auftritt, gibt der Defibrillator automatisch einen Elektroschock ab. Dadurch kann der Herzschlag zumeist sofort wieder in einen regelmäßigen Rhythmus gebracht werden.
Quellen
Richtlinien zur Organtransplantation gem. § 16 Abs. 1 S. 1 Nrn. 2 u. 5 TPG. https://www.bundesaerztekammer.de/ (zuletzt besucht am 18.10.2024).
Left Ventricular Assist Devices - A State of the Art Review.Feldmann C, Chatterjee A, Haverich A, Schmitto JD.Feldmann C, et al. Adv Exp Med Biol. 2018;1067:287-294.
Total artificial heart implantation as a bridge to transplantation: a viable model for the future? Beaupré RA, Frazier OH, Morgan JA.Beaupré RA, et al. Expert Rev Med Devices. 2018 Oct;15(10):701-706.
J Romero, R Chaudhary, J Garg et al. Role of implantable cardioverter defibrillator in non-ischemic cardiomyopathy: a systemc review and meta-analysis of prospective randomized clinical trials. J Interv Card Electrophysiol 2017; 49:263-270.
Chronische Herzinsuffizienz im fortgeschrittenen Stadium - konservativ medikamentöse Therapie, Kunstherz- oder Herztransplantation? Martinelli MV, Bösch C, Signorell J, Mohacsi P.Martinelli MV, et al. Ther Umsch. 2011 Dec;68(12):715-23.
Herold G: Innere Medizin, 2021.